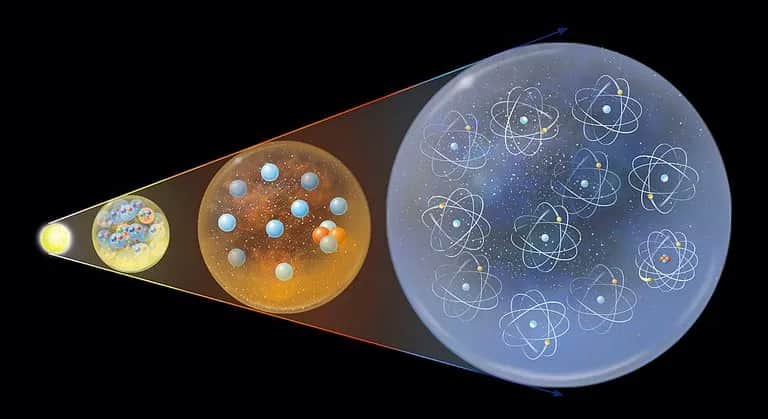
- Atom składa się z jądra, które zawiera protony i neutrony, oraz chmury elektronowej.
- Protony mają ładunek dodatni, a neutrony są neutralne, co wpływa na stabilność jądra atomowego.
- Elektrony, poruszające się wokół jądra, mają ładunek ujemny i decydują o właściwościach chemicznych atomu.
- Rozmieszczenie elektronów w powłokach atomowych wpływa na reactivity i zdolność do tworzenia wiązań chemicznych.
- Istnieją różne rodzaje wiązań chemicznych, takie jak wiązania jonowe, kowalencyjne i metaliczne, które kształtują substancje w naszym otoczeniu.
Jak atom jest zbudowany? Zrozumienie podstawowej struktury
Atom to podstawowa jednostka materii, która tworzy wszystko wokół nas. Jest zbudowany z jądra, które znajduje się w jego centrum, oraz z otaczającej go chmury elektronowej. Jądro atomowe jest dodatnio naładowane i składa się z protonów oraz neutronów, podczas gdy chmura elektronowa, która ma ładunek ujemny, otacza jądro.
Właściwości atomu są ściśle związane z jego strukturą. Zrozumienie tej budowy jest kluczowe dla dalszego poznawania chemii i fizyki. W kolejnych sekcjach przyjrzymy się bliżej składnikom atomu, ich rolom oraz interakcjom, które zachodzą pomiędzy nimi.
Główne składniki atomu: jądro i elektronowa chmura
Atom składa się z dwóch głównych komponentów: jądra oraz chmury elektronowej. Jądro atomowe jest małym, gęstym obszarem, w którym znajdują się protony i neutrony. Protony mają ładunek dodatni, natomiast neutrony są neutralne. Ta struktura jądra sprawia, że atom jest stabilny i ma określoną masę.
Chmura elektronowa otacza jądro i składa się z elektronów, które poruszają się wokół jądra na różnych poziomach energetycznych. Elektrony mają ładunek ujemny i są odpowiedzialne za wiele właściwości chemicznych atomu, takich jak jego zdolność do tworzenia wiązań z innymi atomami. Cała ta złożoność sprawia, że atom jest fascynującym obiektem badań w naukach przyrodniczych.
Rola protonów i neutronów w jądrze atomowym
W jądrze atomowym znajdują się dwa kluczowe składniki: protony i neutrony. Protony są cząstkami naładowanymi dodatnio, co sprawia, że jądro atomowe ma ładunek dodatni. Liczba protonów w jądrze określa, do jakiego pierwiastka należy dany atom; na przykład atom węgla ma sześć protonów, co czyni go węglem. Neutrony, z drugiej strony, są cząstkami neutralnymi, co oznacza, że nie mają ładunku elektrycznego. Ich obecność w jądrze wpływa na stabilność atomu, ponieważ pomagają one zrównoważyć odpychające siły między dodatnio naładowanymi protonami.
Warto zauważyć, że liczba neutronów może się różnić w zależności od izotopu danego pierwiastka. Na przykład, węgiel-12 ma sześć neutronów, podczas gdy węgiel-14 ma ich osiem. Ta różnica w liczbie neutronów nie zmienia właściwości chemicznych pierwiastka, ale wpływa na jego masę oraz stabilność. Zrozumienie roli protonów i neutronów jest kluczowe dla dalszego zgłębiania tematu budowy atomu oraz jego zachowania w różnych reakcjach chemicznych.
Jak elektrony wpływają na właściwości chemiczne atomu
Elektrony odgrywają kluczową rolę w określaniu właściwości chemicznych atomu. To one decydują o tym, jak atomy reagują ze sobą, tworząc różne związki chemiczne. Konfiguracja elektronowa, czyli sposób rozmieszczenia elektronów na powłokach, wpływa na reactivity atomu. Na przykład, atomy o pełnych powłokach elektronowych, takie jak gazy szlachetne, są znane z tego, że są mało reaktywne, ponieważ nie dążą do wymiany ani dzielenia się elektronami.
W przeciwieństwie do tego, atomy z niepełnymi powłokami, takie jak sód czy chlor, są bardziej skłonne do tworzenia wiązań chemicznych, aby osiągnąć stabilność. Reaktywność atomów jest więc ściśle związana z ich konfiguracją elektronową, co czyni elektrony kluczowymi graczami w chemii. Poniżej przedstawiamy kilka przykładów elementów i ich konfiguracji elektronowych, które ilustrują tę zależność:- Węgiel (C): 1s² 2s² 2p²
- Azot (N): 1s² 2s² 2p³
- Chlor (Cl): 1s² 2s² 2p⁶ 3s² 3p⁵
- Neon (Ne): 1s² 2s² 2p⁶
Zasady rozmieszczenia elektronów w powłokach atomowych
Rozmieszczenie elektronów w atomie odbywa się zgodnie z określonymi zasadami, które mają kluczowe znaczenie dla zrozumienia budowy atomu. Elektrony są rozmieszczane na powłokach atomowych w sposób, który minimalizuje energię systemu. Zasada najniższej energii mówi, że elektrony zajmują najpierw najniższe dostępne poziomy energetyczne.
W miarę dodawania elektronów, zajmują one kolejne powłoki zgodnie z określonymi regułami, takimi jak zasada zakazu Pauliego i reguła Hund'a. Zasada zakazu Pauliego stwierdza, że dwa fermiony (takie jak elektrony) nie mogą mieć identycznych stanów kwantowych. Reguła Hund'a wskazuje, że przy rozkładzie elektronów w podpowłokach, należy najpierw zająć wszystkie orbitale pojedynczymi elektronami, zanim zostaną one sparowane. Te zasady są kluczowe dla zrozumienia, jak atomy wchodzą w interakcje i tworzą różne związki chemiczne.
Interakcje atomowe: jak atomy łączą się i oddziałują
Interakcje atomowe są kluczowym aspektem chemii, ponieważ to właśnie dzięki nim atomy mogą łączyć się w różne związki chemiczne. Wiązania chemiczne powstają, gdy atomy dzielą się lub wymieniają elektronami, co prowadzi do stabilizacji ich struktur. Zrozumienie tych interakcji jest istotne dla nauk przyrodniczych, ponieważ wpływa na właściwości substancji oraz ich zachowanie w różnych warunkach.
Na przykład, woda, będąca związkiem chemicznym, powstaje z interakcji atomów wodoru i tlenu. Te interakcje są fundamentem dla wielu procesów biologicznych oraz chemicznych, które zachodzą w naszym codziennym życiu. W kolejnych sekcjach przyjrzymy się różnym rodzajom wiązań chemicznych i ich charakterystykom.
Rodzaje wiązań chemicznych między atomami
W chemii wyróżniamy trzy główne typy wiązań chemicznych: wiązania jonowe, kowalencyjne oraz metaliczne. Wiązania jonowe powstają, gdy atomy przekazują sobie elektrony, co prowadzi do powstania naładowanych jonów, które przyciągają się nawzajem. Przykładem są związki, takie jak chlorek sodu (NaCl), gdzie atom sodu oddaje elektron atomowi chloru.
Wiązania kowalencyjne z kolei polegają na wspólnym dzieleniu elektronów przez atomy, co prowadzi do utworzenia cząsteczek, takich jak cząsteczka wody (H₂O) czy dwutlenku węgla (CO₂). Wiązania metaliczne występują w metalach, gdzie atomy dzielą się „chmurą” elektronów, co pozwala na swobodne poruszanie się elektronów i prowadzi do dobrych właściwości przewodzących metali. Zrozumienie tych typów wiązań chemicznych jest kluczowe dla dalszego zgłębiania tematu chemii i jej zastosowań w praktyce.
Czytaj więcej: Kosmetyki chemia: jakie składniki mogą zagrażać twojemu zdrowiu?
Przykłady zastosowań struktury atomowej w codziennym życiu

Struktura atomowa ma ogromny wpływ na nasze codzienne życie, kształtując właściwości materiałów, które nas otaczają. Atom jest podstawową jednostką materii, a jego składniki decydują o tym, jak substancje reagują i jakie mają właściwości. Na przykład, różne materiały budowlane, takie jak beton czy stal, mają unikalne właściwości mechaniczne dzięki różnym typom wiązań chemicznych między atomami.
Innym przykładem jest woda, która ma wyjątkowe właściwości wynikające z jej struktury atomowej. Woda jest doskonałym rozpuszczalnikiem dzięki polarności cząsteczek, co umożliwia rozpuszczanie wielu substancji. Dodatkowo, struktura atomowa wpływa na właściwości biologiczne, takie jak transport składników odżywczych w organizmach żywych. Zrozumienie, jak atomy tworzą różne związki, pozwala nam lepiej docenić i wykorzystać materiały w naszym otoczeniu.
| Materiał | Właściwości wynikające ze struktury atomowej |
|---|---|
| Woda (H₂O) | Wysoka polarność, doskonały rozpuszczalnik |
| Stal | Wysoka wytrzymałość, odporność na rozciąganie |
| Beton | Dobra wytrzymałość na ściskanie, trwałość |
| Plastik (polietylen) | Elastyczność, odporność na chemikalia |
Jak zrozumienie atomów wpływa na nowoczesne technologie
W miarę jak technologia rozwija się, zrozumienie struktury atomowej staje się kluczowe dla innowacji w wielu dziedzinach. Nanotechnologia to jeden z obszarów, w którym wiedza o atomach i ich interakcjach odgrywa fundamentalną rolę. Dzięki manipulacji atomami i cząsteczkami na poziomie nano, naukowcy mogą tworzyć materiały o unikalnych właściwościach, które są znacznie bardziej efektywne niż tradycyjne substancje. Na przykład, nanocząsteczki srebra wykazują silne właściwości antybakteryjne, co pozwala na ich zastosowanie w medycynie i ochronie zdrowia.
Innym interesującym obszarem jest rozwój materiałów inteligentnych, które reagują na zmiany w otoczeniu. Te materiały, oparte na zrozumieniu struktury atomowej, mogą zmieniać swoje właściwości w odpowiedzi na bodźce zewnętrzne, takie jak temperatura czy pH. Przykładem mogą być materiały stosowane w budownictwie, które dostosowują swoje właściwości izolacyjne w zależności od warunków klimatycznych. Takie innowacje mogą prowadzić do znacznych oszczędności energii i poprawy komfortu życia, pokazując, jak głębokie zrozumienie atomów może mieć realny wpływ na przyszłość technologii i naszego codziennego życia.