Dysocjacja w chemii to kluczowy proces, który polega na rozpadzie substancji na mniejsze cząsteczki lub atomy. Zjawisko to zachodzi pod wpływem różnych czynników, takich jak temperatura czy rozpuszczalnik. Zrozumienie dysocjacji jest istotne, ponieważ wpływa na wiele reakcji chemicznych oraz na właściwości substancji w różnych warunkach. W tym artykule przyjrzymy się bliżej temu procesowi, jego znaczeniu oraz czynnikom, które go kształtują.
Przykłady dysocjacji są obecne w naszym codziennym życiu, od kwasów w napojach, po sole w potrawach. Zrozumienie, jak i dlaczego zachodzi dysocjacja, pozwala lepiej pojąć mechanizmy rządzące reakcjami chemicznymi i ich zastosowaniami w przemyśle oraz biologii.
Kluczowe informacje:- Dysocjacja to proces rozpadu substancji na mniejsze cząsteczki pod wpływem czynników zewnętrznych.
- Główne czynniki wpływające na dysocjację to temperatura i rodzaj rozpuszczalnika.
- Woda jest najczęściej używanym rozpuszczalnikiem, a jej właściwości mają ogromny wpływ na dysocjację substancji.
- Dysocjacja kwasów i zasad jest kluczowa dla zrozumienia ich działania w roztworach wodnych.
- Proces ten ma istotne znaczenie w reakcjach chemicznych, wpływając na równowagę chemiczną.
- Dysocjacja znajduje zastosowanie w różnych dziedzinach, takich jak przemysł farmaceutyczny czy biotechnologia.
Zrozumienie dysocjacji chemicznej i jej znaczenie w chemii
Dysocjacja to kluczowy proces w chemii, który polega na rozpadzie substancji na mniejsze cząsteczki lub atomy. Zachodzi on pod wpływem różnych czynników, takich jak temperatura czy rodzaj rozpuszczalnika. Zrozumienie tego zjawiska jest istotne, ponieważ wpływa na wiele reakcji chemicznych oraz na właściwości substancji w różnych warunkach. Dysocjacja jest niezbędna do zrozumienia, jak substancje chemiczne zachowują się w roztworach i jak reagują ze sobą.
W chemii, proces dysocjacji jest fundamentalny dla wielu dziedzin, w tym dla analizy chemicznej i biologii. Dzięki niemu możemy lepiej zrozumieć, jak różne substancje oddziałują ze sobą oraz jak można je wykorzystać w praktyce. Na przykład, dysocjacja kwasów i zasad odgrywa kluczową rolę w reakcjach chemicznych, co czyni ją niezwykle ważną w laboratoriach i przemyśle.
Definicja dysocjacji i jej podstawowe pojęcia
Dysocjacja to proces, w którym substancja chemiczna rozpada się na mniejsze jednostki, takie jak jony, cząsteczki lub atomy. Jest to zjawisko, które zachodzi, gdy substancja rozpuszcza się w rozpuszczalniku, co prowadzi do uwolnienia jej składników. Kluczowymi pojęciami związanymi z dysocjacją są jony, które są naładowanymi cząstkami powstającymi podczas tego procesu, oraz roztwory, w których dysocjacja ma miejsce.
Jakie są różnice między dysocjacją a innymi procesami chemicznymi?
Dysocjacja różni się od innych procesów chemicznych, takich jak rozkład czy hydroliza, które również prowadzą do zmiany struktury substancji, ale w inny sposób. Rozkład polega na rozpadzie substancji na prostsze składniki, a hydroliza to reakcja z wodą, która często prowadzi do dysocjacji. Dysocjacja koncentruje się na rozdzieleniu cząsteczek w roztworze, co jest kluczowe dla zrozumienia reakcji chemicznych w kontekście ich zachowania w różnych warunkach.
Czynniki wpływające na proces dysocjacji w chemii
Dysocjacja jest procesem, który może być znacząco wpływany przez różne czynniki, w tym temperaturę i rodzaj rozpuszczalnika. Zmiana temperatury może prowadzić do wzrostu energii cząsteczek, co z kolei przyspiesza proces dysocjacji. W wyższych temperaturach cząsteczki poruszają się szybciej, co ułatwia ich interakcje i rozpad na mniejsze jednostki. W ten sposób, wyższa temperatura może zwiększać stopień dysocjacji substancji chemicznych, co jest kluczowe w wielu reakcjach chemicznych.
Oprócz temperatury, rodzaj rozpuszczalnika również ma istotny wpływ na dysocjację. Różne rozpuszczalniki mają różne właściwości chemiczne i fizyczne, co wpływa na zdolność substancji do dysocjacji. Na przykład, woda jako rozpuszczalnik polarny sprzyja dysocjacji wielu substancji, podczas gdy rozpuszczalniki niepolarne mogą nie być tak efektywne. Zrozumienie, jak te czynniki wpływają na dysocjację, jest kluczowe dla chemików pracujących nad różnymi reakcjami i procesami.
Jak temperatura wpływa na dysocjację substancji chemicznych?
Temperatura odgrywa kluczową rolę w procesie dysocjacji substancji chemicznych. Wraz ze wzrostem temperatury, energia kinetyczna cząsteczek wzrasta, co prowadzi do szybszych i bardziej intensywnych zderzeń między cząsteczkami. To zjawisko sprawia, że substancje mają większą tendencję do rozpadania się na mniejsze jednostki, takie jak jony. W praktyce, wyższe temperatury mogą prowadzić do większego stopnia dysocjacji, co ma istotne znaczenie w kontekście wielu procesów chemicznych, takich jak reakcje kwasów i zasad.
Rola rozpuszczalnika w procesie dysocjacji
Rozpuszczalnik odgrywa kluczową rolę w procesie dysocjacji, ponieważ jego właściwości chemiczne i fizyczne wpływają na to, jak substancje chemiczne się rozpadają. Woda, jako najczęściej używany rozpuszczalnik, jest polarnym cieczą, która sprzyja dysocjacji wielu substancji, takich jak kwasy i zasady. Polarny charakter cząsteczek wody umożliwia im oddziaływanie z naładowanymi cząstkami, co prowadzi do ich separacji. Inne rozpuszczalniki, takie jak alkohole czy rozpuszczalniki niepolarne, mogą nie być tak efektywne w procesie dysocjacji, co ogranicza ich zastosowanie w niektórych reakcjach chemicznych.
Właściwości rozpuszczalnika, takie jak jego temperatura wrzenia, gęstość oraz zdolność do tworzenia wiązań wodorowych, również mają wpływ na stopień dysocjacji. Na przykład, w wysokotemperaturowych warunkach, rozpuszczalniki mogą ułatwiać rozpad substancji na jony, co zwiększa ich dostępność w reakcjach chemicznych. Zrozumienie roli rozpuszczalnika w dysocjacji jest kluczowe dla chemików, którzy projektują reakcje i eksperymenty, aby uzyskać pożądane wyniki.
Czytaj więcej: Kto wynalazł atom? Odkryj tajemnice teorii atomowej i jej twórców
Przykłady dysocjacji w praktyce chemicznej
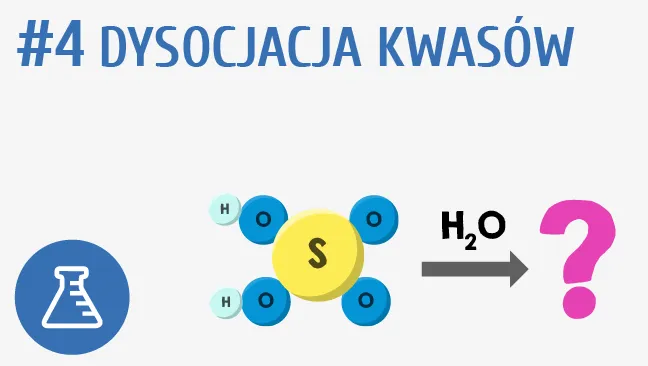
Dysocjacja jest kluczowym zjawiskiem w chemii, które można zaobserwować w przypadku różnych substancji. Przykładem są kwasy, takie jak kwas solny (HCl), który w wodzie dysocjuje na jony wodoru (H⁺) i jony chlorkowe (Cl⁻). Ta dysocjacja jest istotna, ponieważ pozwala na przewodnictwo elektryczne roztworu oraz wpływa na jego właściwości chemiczne. Inny przykład to kwas siarkowy (H₂SO₄), który również dysocjuje w wodzie, tworząc jony H⁺ oraz jony siarczanowe (SO₄²⁻), co czyni go silnym kwasem.
W przypadku zasad, takich jak wodorotlenek sodu (NaOH), dysocjacja również zachodzi w wodzie. Wodorotlenek sodu rozkłada się na jony sodowe (Na⁺) i jony wodorotlenkowe (OH⁻), co prowadzi do zwiększenia zasadowości roztworu. Zrozumienie tych procesów dysocjacji jest kluczowe dla chemików, ponieważ wpływa na reakcje chemiczne oraz właściwości fizyczne i chemiczne substancji w różnych zastosowaniach.Dysocjacja kwasów i zasad w roztworach wodnych
W roztworach wodnych, dysocjacja kwasów i zasad jest procesem fundamentalnym. Na przykład, kwas octowy (CH₃COOH) dysocjuje częściowo w wodzie, tworząc jony H⁺ i jony octanowe (CH₃COO⁻). Ta częściowa dysocjacja oznacza, że kwas octowy jest słabym kwasem. W przeciwieństwie do tego, kwas solny (HCl) dysocjuje całkowicie, co czyni go silnym kwasem. Zrozumienie tych różnic w dysocjacji jest kluczowe dla określenia siły kwasów i zasad oraz ich zastosowań w różnych reakcjach chemicznych.
Przykłady dysocjacji soli i ich zastosowania
Sole, takie jak chlorek sodu (NaCl), również ulegają dysocjacji w wodzie. Kiedy NaCl jest rozpuszczany, dysocjuje na jony sodowe (Na⁺) i jony chlorkowe (Cl⁻). Ta dysocjacja jest ważna w wielu procesach biologicznych, w tym w regulacji ciśnienia osmotycznego w komórkach. Inny przykład to siarczan sodu (Na₂SO₄), który w wodzie dysocjuje na jony sodowe i jony siarczanowe (SO₄²⁻). Sole te mają zastosowanie w przemyśle chemicznym oraz w produkcji detergentów, co podkreśla ich znaczenie w codziennym życiu.
Znaczenie dysocjacji w reakcjach chemicznych i codziennym życiu
Dysocjacja odgrywa kluczową rolę w wielu reakcjach chemicznych, wpływając na ich przebieg oraz efektywność. Proces ten jest istotny w kontekście reakcji kwasów i zasad, gdzie dysocjacja pozwala na powstawanie jonów, które są niezbędne do przeprowadzenia reakcji. Na przykład, w przypadku reakcji neutralizacji, obecność jonów H⁺ i OH⁻ jest kluczowa dla powstania wody. Zrozumienie dysocjacji jest zatem niezbędne dla chemików, którzy muszą przewidzieć, jak różne substancje będą reagować w różnych warunkach.
W codziennym życiu dysocjacja ma również wiele praktycznych zastosowań. Na przykład, w przemyśle farmaceutycznym, dysocjacja leków wpływa na ich biodostępność oraz skuteczność. Woda mineralna zawiera różne sole, które po dysocjacji dostarczają organizmowi niezbędnych elektrolitów. Ponadto, w biologii, procesy dysocjacji są kluczowe dla funkcjonowania komórek, w tym transportu substancji przez błony komórkowe. Zrozumienie tych procesów pozwala na lepsze wykorzystanie wiedzy chemicznej w praktyce.
Jak dysocjacja wpływa na równowagę chemiczną?
Dysocjacja ma istotny wpływ na równowagę chemiczną w reakcjach chemicznych. Kiedy substancje dysocjują, zmienia się stężenie jonów w roztworze, co wpływa na kierunek reakcji. Zasada Le Chateliera wskazuje, że systemy chemiczne dążą do równowagi, a zmiany w stężeniu produktów lub reagentów mogą przesunąć tę równowagę. Na przykład, w przypadku reakcji, w której kwas dysocjuje na jony, zwiększenie stężenia tych jonów może prowadzić do przesunięcia równowagi w kierunku produktów, co jest kluczowe dla zrozumienia mechanizmów reakcji chemicznych.
Praktyczne zastosowania dysocjacji w przemyśle i biologii
Dysocjacja znajduje szerokie zastosowanie w różnych dziedzinach, takich jak przemysł farmaceutyczny, rolnictwo oraz biotechnologia. W farmacji, zrozumienie dysocjacji leków pozwala na projektowanie bardziej efektywnych preparatów, które lepiej wchłaniają się w organizmie. W rolnictwie, dysocjacja nawozów mineralnych jest kluczowa dla zapewnienia roślinom odpowiednich składników odżywczych. W biotechnologii, procesy dysocjacji są istotne dla wielu reakcji enzymatycznych, które są niezbędne do funkcjonowania organizmów. W każdej z tych dziedzin, zrozumienie dysocjacji pozwala na optymalizację procesów i zwiększenie ich efektywności.
Przyszłość dysocjacji: zastosowania w nanotechnologii i medycynie
W miarę jak rozwija się nanotechnologia, dysocjacja staje się kluczowym procesem w tworzeniu nowych materiałów oraz w medycynie. Na przykład, wykorzystanie dysocjacji w syntezie nanocząsteczek może prowadzić do powstania zaawansowanych leków, które są bardziej efektywne w dostarczaniu substancji czynnych bezpośrednio do komórek. Dzięki precyzyjnemu kontrolowaniu dysocjacji, naukowcy mogą projektować leki, które uwalniają swoje składniki w odpowiednich warunkach, co zwiększa ich skuteczność oraz minimalizuje skutki uboczne.
W medycynie, zrozumienie procesów dysocjacji może również wpłynąć na rozwój nowych metod diagnostycznych. Na przykład, techniki oparte na dysocjacji mogą być stosowane do monitorowania stężenia jonów w organizmie, co jest istotne w diagnostyce chorób metabolicznych. Takie podejście może prowadzić do bardziej precyzyjnych i szybkich testów, które umożliwią lekarzom lepsze dostosowanie terapii do indywidualnych potrzeb pacjentów. W ten sposób, przyszłość dysocjacji w nanotechnologii i medycynie obiecuje rewolucję w sposobie, w jaki opracowujemy i stosujemy leki oraz materiały.

