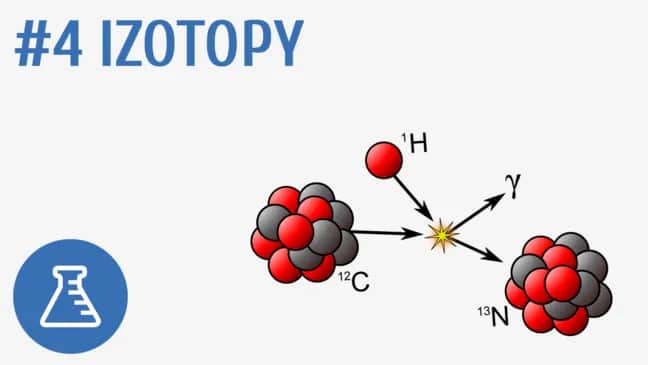
Izotopy odgrywają ważną rolę w naszym życiu, od diagnostyki medycznej po badania naukowe. Dzięki nim możemy lepiej zrozumieć procesy zachodzące w naturze oraz wykorzystać je w praktycznych zastosowaniach. W dalszej części artykułu omówimy przykłady powszechnych izotopów, ich właściwości oraz potencjalne zagrożenia związane z izotopami radioaktywnymi.
Kluczowe wnioski:- Izotopy są różnymi formami atomów tego samego pierwiastka, różniącymi się liczbą neutronów.
- Właściwości izotopów mogą się różnić, co ma znaczenie w chemii i medycynie.
- Przykłady kluczowych izotopów to izotopy wodoru, węgla i uranu.
- Izotopy są wykorzystywane w diagnostyce medycznej, takich jak PET, oraz w badaniach naukowych.
- Ważne jest zrozumienie bezpieczeństwa i potencjalnych zagrożeń związanych z izotopami radioaktywnymi.
Izotopy - definicja i podstawowe pojęcia w chemii
Izotopy to różne formy atomów tego samego pierwiastka chemicznego, które różnią się liczbą neutronów w jądrze atomowym. Oznacza to, że izotopy mają tę samą liczbę protonów, ale ich masa atomowa jest inna. Na przykład, izotopy węgla, takie jak węgiel-12 i węgiel-14, mają różną liczbę neutronów, co wpływa na ich właściwości fizyczne. Izotopy powstają w różnych procesach naturalnych, takich jak reakcje jądrowe w gwiazdach czy rozpad radioaktywny.
W chemii, zrozumienie izotopów jest kluczowe dla wielu dziedzin, w tym dla analizy chemicznej i badań naukowych. Dzięki izotopom możemy śledzić reakcje chemiczne i zrozumieć mechanizmy ich przebiegu. Izotopy mają również zastosowanie w medycynie, energetyce oraz ochronie środowiska, co czyni je niezwykle ważnym tematem w naukach przyrodniczych.
Co to są izotopy i jak powstają w naturze?
Izotopy to atomy tego samego pierwiastka, które różnią się liczbą neutronów. Na przykład, azot ma dwa stabilne izotopy: azot-14 i azot-15. Izotopy powstają w wyniku różnych procesów, takich jak reakcje jądrowe, które zachodzą w gwiazdach, lub w wyniku rozpadu radioaktywnego. W naturalnym świecie, izotopy mogą być także wytwarzane przez bombardowanie atomów neutronami lub innymi cząstkami subatomowymi. W wyniku tych procesów powstają różne izotopy, które mogą mieć różne właściwości chemiczne i fizyczne.
Różnice między izotopami a innymi formami atomów
Izotopy różnią się od innych form atomów, takich jak jony i alotropowe formy. Jony to atomy, które mają różną liczbę elektronów, co skutkuje ładunkiem elektrycznym. W przeciwieństwie do izotopów, które mają tę samą liczbę protonów, ale różną liczbę neutronów, jony mogą być dodatnie lub ujemne. Z kolei allotropy to różne formy tego samego pierwiastka, które różnią się strukturą atomową, na przykład węgiel występuje jako diament i grafit. Oprócz tego, izotopy mają różne właściwości fizyczne i chemiczne, co czyni je unikalnymi w porównaniu do innych form atomów.
Warto zauważyć, że izotopy mogą być stabilne lub niestabilne, podczas gdy inne formy atomów, takie jak jony, są zazwyczaj stabilne w danych warunkach. Izotopy są kluczowe w wielu dziedzinach nauki, ponieważ pozwalają na badanie procesów chemicznych i fizycznych poprzez śledzenie zmian w reakcjach. Różnice te są istotne dla zrozumienia, jak różne formy atomów wpływają na właściwości substancji.
Przykłady powszechnych izotopów i ich właściwości
Izotopy występują w wielu pierwiastkach chemicznych i mają różnorodne właściwości. Na przykład, węgiel ma dwa stabilne izotopy: węgiel-12 i węgiel-13, które różnią się liczbą neutronów. Izotopy mogą mieć różne masy atomowe, co wpływa na ich zachowanie w reakcjach chemicznych. Warto również wspomnieć o izotopach radioaktywnych, takich jak węgiel-14, który jest używany w datowaniu radiowęglowym. Te różnice w właściwościach izotopów są kluczowe dla ich zastosowania w różnych dziedzinach nauki.
Właściwości izotopów mogą wpływać na ich stabilność i reakcje chemiczne. Na przykład, izotopy o większej liczbie neutronów mogą być mniej stabilne i bardziej podatne na rozpad radioaktywny. Dzięki zrozumieniu tych właściwości, naukowcy mogą wykorzystać izotopy w badaniach naukowych oraz w praktycznych zastosowaniach, takich jak medycyna czy przemysł. Oto tabela przedstawiająca kilka powszechnych izotopów i ich właściwości:
| Izotop | Liczba neutronów | Stabilność |
| Węgiel-12 | 6 | Stabilny |
| Węgiel-13 | 7 | Stabilny |
| Węgiel-14 | 8 | Radioaktywny |
Izotopy wodoru, węgla i uranu - kluczowe przykłady
Izotopy wodoru to doskonały przykład różnorodności atomów tego samego pierwiastka. Wodór występuje w trzech izotopach: wodór-1 (protium), wodór-2 (deuter) i wodór-3 (tryt). Protium jest najpowszechniejszym izotopem, mającym jeden proton i zero neutronów, podczas gdy deuter ma jeden neutron, a tryt - dwa neutrony. Deuter jest używany w badaniach chemicznych i jako paliwo w reakcjach fuzji jądrowej, a tryt znajduje zastosowanie w technologii nuklearnej oraz w produkcji izotopowych znaczników.
Kolejnym istotnym izotopem jest węgiel, który ma trzy stabilne izotopy: węgiel-12, węgiel-13 i radioaktywny węgiel-14. Węgiel-12 jest najczęściej występującym izotopem, stanowiącym około 99% naturalnego węgla. Węgiel-13, choć mniej powszechny, jest cenny w spektroskopii NMR i badaniach biologicznych. Węgiel-14 jest znany z zastosowania w datowaniu radiowęglowym, które pozwala określić wiek organicznych materiałów. Dzięki różnym izotopom węgla, naukowcy mogą śledzić procesy biologiczne oraz zmiany w środowisku.
Izotopy uranu, zwłaszcza uran-238 i uran-235, są kluczowe w energetyce jądrowej. Uran-238 jest najpowszechniejszym izotopem uranu, ale nie jest bezpośrednio używany jako paliwo w reaktorach jądrowych. Z kolei uran-235, który stanowi jedynie około 0,7% naturalnego uranu, jest izotopem rozszczepialnym i jest kluczowy dla produkcji energii jądrowej. Uran-235 jest wykorzystywany w reaktorach jądrowych oraz w produkcji broni jądrowej, co czyni go jednym z najważniejszych izotopów w kontekście bezpieczeństwa i energii.Jak liczba neutronów wpływa na właściwości izotopów?
Liczba neutronów w jądrze atomowym ma kluczowy wpływ na właściwości izotopów. Izotopy tego samego pierwiastka różnią się masą atomową, co wpływa na ich stabilność oraz zachowanie w reakcjach chemicznych. Izotopy z większą liczbą neutronów mogą być mniej stabilne i bardziej podatne na rozpad radioaktywny. Na przykład, węgiel-14, który ma dodatkowy neutron w porównaniu do węgla-12, jest radioaktywny i ulega rozpadowi, co czyni go użytecznym narzędziem w datowaniu organicznych materiałów. Różnice w liczbie neutronów wpływają również na właściwości fizyczne, takie jak gęstość i temperatura wrzenia, co czyni izotopy unikalnymi w różnych zastosowaniach naukowych i przemysłowych.
Znaczenie izotopów w chemii i ich zastosowania
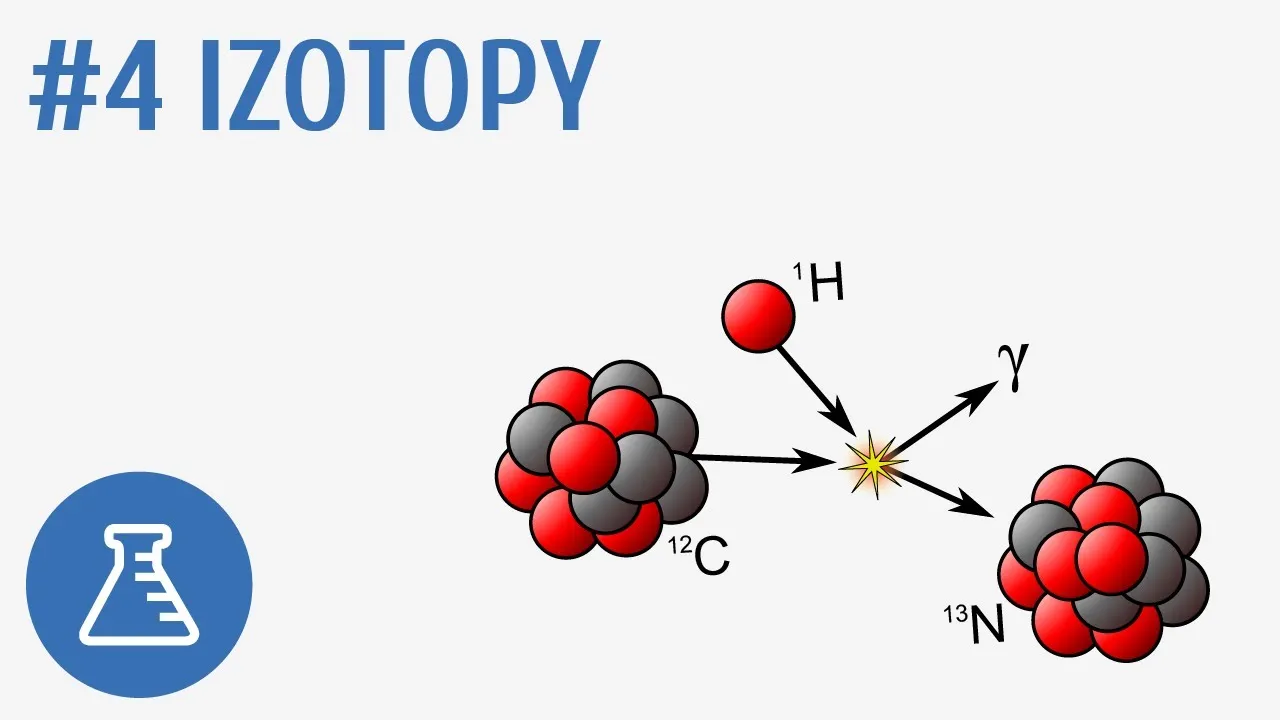
Izotopy odgrywają kluczową rolę w wielu dziedzinach chemii oraz nauk przyrodniczych. Dzięki różnorodności izotopów, naukowcy mogą prowadzić badania nad reakcjami chemicznymi, ich mechanizmami oraz właściwościami substancji. Izotopy są również istotne w diagnostyce medycznej, gdzie ich unikalne właściwości pozwalają na śledzenie procesów biologicznych. W kontekście badań środowiskowych, izotopy pomagają w analizie zmian klimatycznych oraz w monitorowaniu zanieczyszczeń. Warto zauważyć, że zrozumienie izotopów jest kluczowe dla postępu w chemii i technologii.
W zastosowaniach przemysłowych, izotopy znajdują szerokie zastosowanie w różnych procesach, takich jak kontrola jakości materiałów, produkcja energii oraz w technologii żywności. Na przykład, izotopy są wykorzystywane w radiografii przemysłowej do wykrywania wad w materiałach. W medycynie, izotopy są niezbędne w terapii nowotworowej, diagnostyce obrazowej oraz w badaniach klinicznych. Poniżej znajduje się lista zastosowań izotopów w różnych dziedzinach:- Diagnostyka medyczna (np. PET, SPECT)
- Datowanie radiowęglowe w archeologii
- Badania środowiskowe i monitoring zanieczyszczeń
- Produkcja energii jądrowej
- Radiografia przemysłowa dla kontroli jakości
Izotopy w medycynie - diagnostyka i terapia
Izotopy mają ogromne znaczenie w medycynie, zwłaszcza w diagnostyce i terapii. Na przykład, izotop węgla-14 jest używany w badaniach metabolicznych, a izotopy technetu-99m są szeroko stosowane w diagnostyce obrazowej, takich jak scyntygrafia. Dzięki tym izotopom lekarze mogą uzyskać szczegółowe obrazy narządów wewnętrznych i monitorować funkcje metaboliczne pacjentów. Izotopy radioaktywne, takie jak jod-131, są wykorzystywane w terapii nowotworowej, pomagając w leczeniu chorób tarczycy. W ten sposób izotopy przyczyniają się do poprawy diagnostyki i efektywności leczenia w medycynie.
Wykorzystanie izotopów w badaniach naukowych i przemysłowych
Izotopy mają szerokie zastosowanie w badaniach naukowych oraz w przemyśle. W naukach przyrodniczych, izotopy są wykorzystywane do badania procesów biologicznych i chemicznych. Na przykład, izotopy węgla, takie jak węgiel-13, są używane w badaniach metabolizmu roślin i zwierząt, co pozwala na lepsze zrozumienie cyklu węgla w ekosystemach. W przemyśle, izotopy są stosowane do wykrywania wad w materiałach oraz w monitorowaniu procesów produkcyjnych, co zwiększa efektywność i bezpieczeństwo operacji.
Izotopy radioaktywne znajdują również zastosowanie w badaniach geologicznych i środowiskowych. Na przykład, izotopy uranu i toru są używane do określenia wieku skał i osadów, co pomaga w rekonstrukcji historii geologicznej Ziemi. W dziedzinie ochrony środowiska, izotopy są wykorzystywane do śledzenia źródeł zanieczyszczeń oraz monitorowania zmian klimatycznych, co jest kluczowe dla podejmowania działań na rzecz ochrony środowiska. W ten sposób izotopy przyczyniają się do postępu w nauce i technologii.
Izotopy a bezpieczeństwo - co warto wiedzieć?
Bezpieczeństwo związane z używaniem izotopów, szczególnie radioaktywnych, jest niezwykle istotne. Izotopy radioaktywne mogą stwarzać zagrożenie dla zdrowia ludzi oraz środowiska, jeśli nie są stosowane z odpowiednimi środkami ostrożności. Dlatego ważne jest, aby przestrzegać rygorystycznych norm i przepisów dotyczących ich przechowywania, transportu i użycia. W miejscach, gdzie używa się izotopów, konieczne są odpowiednie procedury ochrony, aby zminimalizować ryzyko narażenia na promieniowanie.
Potencjalne zagrożenia związane z izotopami radioaktywnymi
Izotopy radioaktywne niosą ze sobą konkretne ryzyko, głównie związane z promieniowaniem. Ekspozycja na promieniowanie może prowadzić do uszkodzeń komórek, co zwiększa ryzyko nowotworów oraz innych chorób. Ponadto, niewłaściwe składowanie izotopów może prowadzić do skażenia środowiska, co stanowi zagrożenie dla zdrowia ludzi i zwierząt. W związku z tym, konieczne jest stosowanie odpowiednich procedur zabezpieczających oraz regularne szkolenie personelu, aby zapewnić bezpieczeństwo w pracy z izotopami radioaktywnymi.
Nowe kierunki w badaniach izotopów i ich zastosowania
W miarę postępu technologicznego, badania nad izotopami otwierają nowe możliwości w różnych dziedzinach, takich jak medycyna, energetyka i ochrona środowiska. Jednym z obiecujących kierunków jest rozwój izotopowych znaczników w terapii celowanej, które mogą precyzyjnie dostarczać leki do komórek nowotworowych, minimalizując skutki uboczne. Tego rodzaju innowacje mogą zrewolucjonizować sposób leczenia chorób, oferując bardziej efektywne i mniej inwazyjne metody.Dodatkowo, w kontekście zmian klimatycznych, izotopy są wykorzystywane do modelowania i prognozowania skutków globalnego ocieplenia. Dzięki analizie izotopowej, naukowcy mogą lepiej zrozumieć cykle węgla i azotu w ekosystemach, co pozwala na opracowanie skuteczniejszych strategii ochrony środowiska. W przyszłości, rozwój technologii związanych z izotopami może przyczynić się do bardziej zrównoważonego rozwoju oraz lepszego zarządzania zasobami naturalnymi, co jest kluczowe w obliczu rosnących wyzwań ekologicznych.